En la vida cotidiana siempre interactuamos con las sustancias llamadas acidos y bases, pero el problema es que no las sabemos identificar.
Por lo cual hemos creado este blog para informar mas detallamente lo que es un acido y una base y como poder identificarlos.
Cabe mencionar que es muy importante tener en cuenta estos conocimientos ya que por medio de ellos podemos saber que sustancias tenemos en nuestro hogar y que tan dañinas pueden ser para nuestra salud y la de nuestra familia, ya que por la falta de informacion podemos llegar a consecuencias leves o inclusive a algo peor: como la murte.
ÁCIDOS
Los ácidos son  sustancias puras que, en disolución acuosa, poseen un sabor característico. Este sabor nos es familiar por tres ácidos orgánicos que nos son bien conocidos: el ácido acético, presente en el vinagre; el ácido cítrico, presente en los frutos cítricos (limón, naranja, pomelo), y el ácido málico, presente en las manzanas.
sustancias puras que, en disolución acuosa, poseen un sabor característico. Este sabor nos es familiar por tres ácidos orgánicos que nos son bien conocidos: el ácido acético, presente en el vinagre; el ácido cítrico, presente en los frutos cítricos (limón, naranja, pomelo), y el ácido málico, presente en las manzanas.
 sustancias puras que, en disolución acuosa, poseen un sabor característico. Este sabor nos es familiar por tres ácidos orgánicos que nos son bien conocidos: el ácido acético, presente en el vinagre; el ácido cítrico, presente en los frutos cítricos (limón, naranja, pomelo), y el ácido málico, presente en las manzanas.
sustancias puras que, en disolución acuosa, poseen un sabor característico. Este sabor nos es familiar por tres ácidos orgánicos que nos son bien conocidos: el ácido acético, presente en el vinagre; el ácido cítrico, presente en los frutos cítricos (limón, naranja, pomelo), y el ácido málico, presente en las manzanas.En química inorgánica existen dos tipos de ácidos:
Ácidos binarios o hidrácidos, constituidos por un no metal (aunque no todos los no metales forman hidrácido) e hidrógeno.
Ácidos ternarios u oxácidos, constituidos por un no metal, oxígeno e hidrógeno.
Ácidos ternarios u oxácidos, constituidos por un no metal, oxígeno e hidrógeno.
Todos los ácidos contienen hidrógeno, pero el hecho de que una sustancia contenga hidrógeno no significa que deba tratarse necesariamente de un ácido.
La reacción de síntesis de los hidrácidos se ajusta al siguiente esquema:
No metal + hidrógeno------ hidrácido
Mientras que los de los oxácidos se forman según la reacción
Óxido ácido + agua-----oxácido
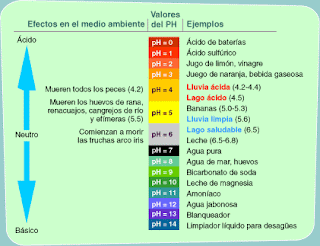
El más conocido de los hidrácidos es el ácido clorhídrico que es el responsable de la acidez del jugo gástrico, mientras que entre los oxácidos es muy conocido el ácido sulfúrico
(Llamado antiguamente aceite de vitriolo), que es el principal responsable de la lluvia ácida, tan perjudicial para los bosques.
Características de los ácidos:
El ión hidrogeno (H+) es constituyente especial de todos ellos.
Poseen un sabor agrio.-ácido.
Reaccionan con algunos metales desprendiendo hidrógeno (como en el Zn) anaranjado de metilo se torna a color rojo; en unaa solución de azul de tornasol colorean de rojo y con la fenolftaleína no produce coloración alguna.
Algunas otras conducen la electricidad en disolución acuosa.
Generalmente son corrosivos.
Reaccionan con las bases produciendo sales.
No metal + hidrógeno------ hidrácido
Mientras que los de los oxácidos se forman según la reacción
Óxido ácido + agua-----oxácido
El más conocido de los hidrácidos es el ácido clorhídrico que es el responsable de la acidez del jugo gástrico, mientras que entre los oxácidos es muy conocido el ácido sulfúrico
(Llamado antiguamente aceite de vitriolo), que es el principal responsable de la lluvia ácida, tan perjudicial para los bosques.
Características de los ácidos:
El ión hidrogeno (H+) es constituyente especial de todos ellos.
Poseen un sabor agrio.-ácido.
Reaccionan con algunos metales desprendiendo hidrógeno (como en el Zn) anaranjado de metilo se torna a color rojo; en unaa solución de azul de tornasol colorean de rojo y con la fenolftaleína no produce coloración alguna.
Algunas otras conducen la electricidad en disolución acuosa.
Generalmente son corrosivos.
Reaccionan con las bases produciendo sales.